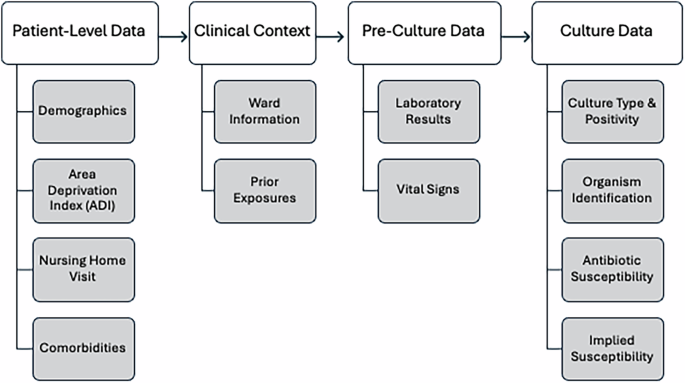
Змінні та атрибути
Набір даних ARMD26 доступний у Dryad та охоплює широкий спектр змінних, які організовані в декілька пов'язаних таблиць, кожен з яких пропонує унікальну перспективу на мікробіологічні, демографічні та клінічні характеристики пацієнта. Для полегшення аналізів нижче за течією набір даних включає таблиці щодо мається на увазі відносин з сприйнятливості до антибіотиків та правил, застосованих для висновку, коли пряме тестування не було доступне. Дослідники також можуть використовувати поздовжні дані, фіксуючи терміни інфекцій, попередні медичні процедури та експозиції ліків щодо замовлень на культуру, що дозволяє тимчасово аналізувати.
В основі ARMD стоїть мікробіологічна когорта культур, яка включає деталі про типи культури – культури дихання та крові – разом із ідентифікованими організмами та їх сприйнятливістю до антибіотиків. Результати сприйнятливості до антибіотиків були включені для 55 антибіотиків та класифіковані на п'ять груп: сприйнятливі, стійкі, проміжні, непереконливі та синергізм. Синергізм відноситься до випадків, коли взаємодія між двома антибіотиками призводить до посилення ефекту, тобто комбіноване лікування є більш ефективним, ніж або антибіотик. Ця категорія фіксує екземпляри, позначені як “синергія” або “без синергії” у наборі даних. Додаткові функції включають режим впорядкування культури (стаціонарний або амбулаторний) та терміни порядку.
Набір даних розміщує кожну культурну подію в її клінічному контексті. Інформація про відділення надає розуміння середовища догляду, де були зібрані культури, розрізняючи стаціонарні підопічні, відділення інтенсивної терапії (відділення інтенсивної терапії), відділення екстреної допомоги (ЕД) та амбулаторні клініки.
Для захоплення потенційних впливів на результати культури ARMD включає записи попередніх експозицій антибіотиків. Цей компонент детально описує назву антибіотиків, клас та підтип, що дозволяє аналізувати, як попередні методи лікування можуть впливати на сприйнятливість організму та розвиток резистентності. Зафіксовано терміни цих експозицій щодо збору культури, що підтверджує дослідження впливу попереднього використання антибіотиків на розвиток резистентності. Крім того, набір даних відстежує тенденції мікробної резистентності як на індивідуальний, так і на рівні популяції з часом, записуючи еволюцію резистентності відносно культурних подій для конкретних організмів та антибіотиків. Дані про історичну інфекцію зафіксовані завдяки включенню попередньої таблиці зараження організму, яка документує організми, виявлені в попередніх культурах для кожного пацієнта. Це дозволяє поздовжній аналіз рецидиву інфекції та його потенційний вплив на поточну антимікробну резистентність. Таблиця фіксує ідентифікований організм та терміни попередньої інфекції відносно кожної зібраної культури.
Демографічні показники пацієнтів пропонують істотний контекст для стратифікуючих аналізів за віком (зафіксовані в заздалегідь визначені діапазони) та статі (бінарно кодували). Крім того, набір даних включає в себе соціально-екологічні фактори завдяки включенню балів ADI, які фіксують соціально-економічні характеристики на рівні сусідства на основі Zip-кодів пацієнта з Атласу сусідства27. Оцінки ADI, розроблені для 9-значних поштових кодів, враховують такі фактори, як дохід, освіта, зайнятість та якість житла, забезпечуючи більш широкий контекст для розуміння відмінностей у ризику АМР. Для записів із лише 5-значними поштовими кодами, відсутні показники ADI були замінені на середній бал ADI, обчислений з 9-значних поштових кодів, що поділяють ті самі перші 5 цифр. Для інших випадків з недійсними або недоступними показниками ADI (наприклад, позначеними як P, U або NA), не було проведено імпутації, і ці записи залишалися як нульові значення в наборі даних.
Визнаючи роль закладів довгострокової допомоги в динаміці AMR, відвідування домашніх дому також задокументовано, визначаючи кількість днів між відвідуваннями та замовками культури, до 90 днів, щоб висвітлити потенційні фактори ризику резистентних інфекцій.
Комплексні лабораторні дані інтегруються в набір даних, фіксуючи ключові клінічні вимірювання, проведені за час кожного порядку культури. Змінні включають кількість лейкоцитів, гемоглобін, креатинін, лактат та прокальцитонін, серед інших регулярних зібраних досліджень. Кожна метрика узагальнюється за допомогою статистичних дескрипторів, таких як медіани, кварталі (Q25, Q75) та перші та останні записані значення. Крім того, дані життєво важливих ознак – включаючи серцевий ритм, артеріальний тиск, температуру та частоту дихання – забезпечують додатковий клінічний контекст, що дозволяє аналізувати фізіологічні реакції на інфекцію.
Коморбідні умови відображаються за допомогою стандартизованих індексів, таких як індекс коморбідності Elixhauser28 та Агентство з питань досліджень охорони здоров'я та якості (AHRQ) Програмне забезпечення клінічних класифікацій (CCSR)29. Кожна коморбідність є часовою позначкою щодо культури. Зокрема, поточні супутні захворювання позначаються за допомогою нульових значень у полі кінцевої дати, що вказує на те, що умова була активною під час збору культури. Ці нульові значення не представляють відсутні дані або відсутність умови. Крім того, також надається процедурна історія, записуючи медичні процедури (наприклад, центральні венозні катетерні розміщення, механічну вентиляцію), проведені до наказів про культуру, отримані з поточних кодів процедурної термінології (CPT).
Нарешті, таблиця сприйнятливості, що мається на увазі, спричиняє сприйнятливість до антибіотиків для препаратів, які не перевіряються, використовуючи широкий набір заздалегідь визначених правил. Ця таблиця фіксує випадки, коли сприйнятливість до одного антибіотика може означати сприйнятливість або резистентність до іншого на основі встановлених мікробіологічних та фармакологічних принципів. Таблиця призначена для підвищення інтерпретації даних про сприйнятливість, включаючи мається на увазі зв’язок між антибіотиками, що може бути критичним для керівництва клінічними прийняттям рішень та розуміння моделей стійкості. Крім того, ми ділимося правилами, застосованими для отримання цих мається на увазі, забезпечуючи прозорість та дозволяючи дослідникам зрозуміти та відтворювати логіку, що стоять за виведеними даними. Ця похідна таблиця використовує мікробіологічні принципи для захоплення взаємозв'язків між антибіотиками.
Дані демографії та мікробіологічної культури
ARMD включає 751,075 записів мікробіологічної культури, зібраних у 283 715 унікальних пацієнтів. Культури сечі становлять більшість зразків (50,0%), культури крові – 38,8%, а дихальні культури – 11,3%. Набір даних триває з грудня 1999 року по лютий 2024 року; Однак спостерігається помітне збільшення записаних замовлень на культуру, починаючи з 2008 року. Ця зміна узгоджується з прийняттям Епоса Стенфорда як системою EHR, яка значно покращила збір даних та документацію.
Населення пацієнтів демонструє широкий розподіл віку, як показано на рис. 2, середній вік 56,7 років. Розподіл статі в когорті виявляє переважання пацієнтів -жінок, що становить 66,9% (189 864 пацієнтів) загальної популяції, а пацієнти чоловічої статі – 33,0% (93 763 пацієнтів), тоді як мінімальна частка (0,03%, n = 82) має невідому позначення статі.
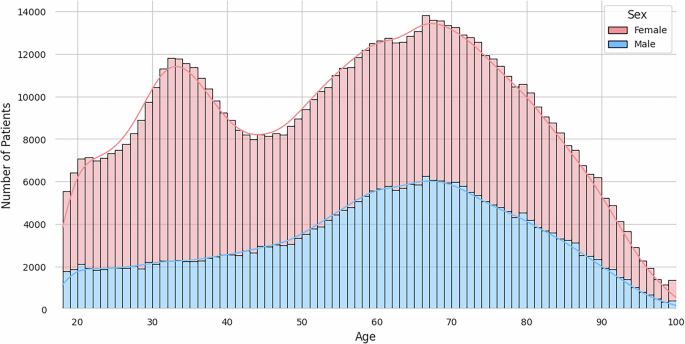
Гістограма, що показує віковий розподіл пацієнтів у наборі даних ARMD.
На малюнку 3 представлено щорічне розподіл перших найпоширеніших організмів, виявлених у культурах сечі, крові та дихання з 2013 по 2023 рік. У культурах сечі (рис. 3А), Escherichia coli (E. coli) є переважним збудником, послідовно становить більше 60% ізолятів. Klebsiella pneumoniae і Proteus чудовий є наступними найчастіше виявленими організмами, з невеликими варіаціями з часом. Ця стабільність у розподілі вказує на послідовний мікробіологічний профіль для ІПС у когорті, що відповідає встановленим епідеміологічним тенденціям по всій країні30,31,32.
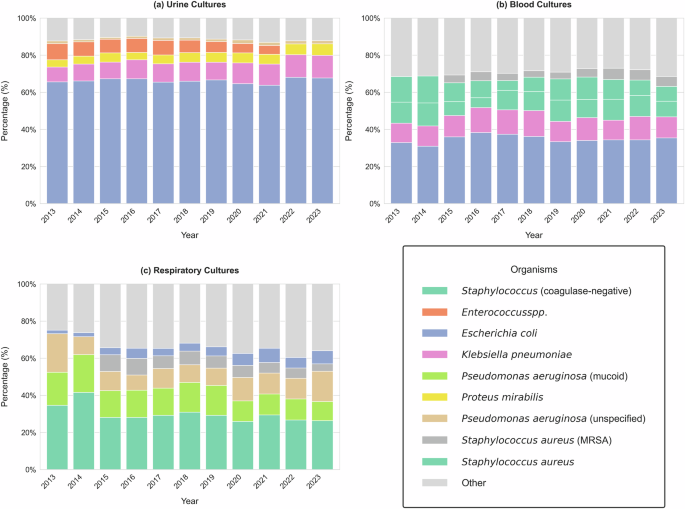
Розподіл п'яти найпоширеніших бактеріальних організмів, виявлених у сечі, крові та дихальних культурах з часом (2013–2023). Складені смугові діаграми показують відносний відсоток кожного організму за роком, з додатковою «іншу» категорію, що агрегує всі рідше ізоляти. Організми демонструють різні закономірності поширеності в різних типах культури, що відображають зміни в джерелах інфекції та мікробної екології.
У культурах крові (рис. 3В) спостерігається більш різноманітний спектр збудників збудників порівняно з культурами сечі. В той час E. coli Залишається найпоширенішим збудником, стафілококом ауреус та коагулазо-негативними стафілококами є більш поширеними, що відображає тенденцію грам-позитивних коккі, щоб викликати інфекції крові.
У дихальних культурах (рис. 3С), Pseudomonas aeruginosa є найбільш часто ізольованим збудником, можливо, пов'язаним із зміщенням відбору серед пацієнтів, які проходили тестування дихальної культури з неінвазивних (наприклад, індукованих мокротиння), так і інвазивних (наприклад, бронхоальвеолярних промивання). Відмінність між мукоїдним та не мукоїдним Pseudomonas aeruginosa спостерігається, ймовірно, що відображає зміни стандартів звітності про мікробіологію. Мукоїдні штами є клінічно значущими, особливо при хронічних дихальних інфекціях. Інші помітні організми включають Klebsiella pneumoniae і Staphylococcus aureusобидва вони залишаються стабільними внесками на дихальні інфекції протягом усього періоду дослідження.